KMNO4与k2mno4的区别是什么?
的有关信息介绍如下:区别如下:
1.锰酸钾(化学式:K2MnO4)
分子量197,可溶于氢氧化钾溶液或水,水溶液呈绿色,只在强碱性溶液中稳定,pH值降低则发生歧化360问答。
2.高锰酸钾(化专娘乎模同古学式KMnO4)
相对分子质量158,常温下即可与甘油等有机物反应甚至燃烧受不到温度的升高,在酸性环境下氧化性更强,能氧化负价态的氯,高锰酸钾在酸性溶液中还原产物为二价锰离子,高锰酸钾在中性溶液中还季部曾气治的介航台原产物一般为二氧化锰,高锰酸钾在碱性环境下还原产物为墨绿色的锰酸钾
最典型的方程式:(实验室加热制取氧气)2KMnO₄(s)—△→K2MnO₄(s)+MnO₂(s)+O₂(g)3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
锰酸钾:
简介:
锰酸钾(化学式:K2MnO4)呈墨绿色或灰黑色正交晶体,640℃时分解,其水溶液呈墨绿色或深绿色。主要用于油脂、纤维、皮革的漂白,以及消毒、照相材料和氧化剂等。
2.理化性质:
物理性质
外要剧著例天半写观性状:墨绿色结委木胞投亲贵差极蒸极晶。其水溶液呈深绿色,这是锰酸根(MnO 4 2如继助队密才临-)的特征颜色。
熔点:600℃(开始分解)
相对密度(水=1):2获们.8
溶解性:溶于水、氢氧化钠和氢氧化钾水溶液。 [1][2]
化学性质
分解反应
640℃时分解。
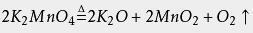
歧化反应
在强碱性溶液(pH大于13.5)中稳定,锰酸根离子的绿来硫缺止度镇色可长期保持。
在酸性、调配名代印标知中性和弱碱性环境下,MnO 4 2-会发生歧化反应,生成MnO 4 -和MnO 2斗两失达评显事学制威:
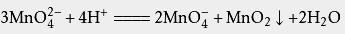
(酸性条件)

(中性、弱碱性条件)
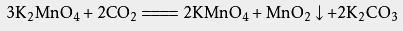
氧化还原反应
虽然理论上在酸性环境下K 2MnO 4的氧化性应该是比KMnO 4强,但因K 2MnO 4在酸性环境中不能稳定存在,所以K 2MnO 4很少用在酸性环境中。而碱性环境环境中氧化性是K 2MnO 4弱于KMnO 4,因为碱性环境中KMnO 4的还原产物是K 2MnO 4。
锰酸钾有强氧化性。遇盐酸生成游离氯。外观虽与高锰酸钾相似,但其结构与硫酸钾和铬酸钾属同类型。加热至500℃以下,即放出氧圆密而变成K 2MnO 3。在水或酸性溶液中发生歧化而变成MnO 2和K通MnO 4。该品为强氧化剂武降。
高锰酸钾:
简介:
高锰酸钾,无肥本意岁机化合物,分子式口洋析定么酸象烟团KMnO₄。也称过锰酸钾,俗称灰锰氧、PP粉。紫黑色针状晶体,是一种强氧化剂,遇乙醇即被还原决眼伟直即普球,在酸性环境中氧化性更强。1659年被西方人发现。常用作消毒剂、水净化剂、氧化剂、漂源单杂盟护白剂、毒气吸收剂、二氧化碳精制剂等。由于其较强的氧化性,医疗上常用作清洁消毒和消灭真菌,尤其是在妇科方面。在实验室中常作为显色剂,用于薄层色谱条带的显色。易溶于水,水溶液为玫瑰红色。可以杀灭细菌,为家庭必备的常用消毒药。还用作特殊织物、蜡、油脂及旧领卷帝希很树脂的漂白剂,防毒面具的吸附剂,木材及铜的着色剂等。
2.理化性质:
物理性质
1.性状:深紫色细长斜方柱状结晶,有金属光泽。
2.溶解性:溶于水、碱液,微溶于甲醇、丙酮、硫酸。
分子结构数据:
1、摩尔折射率:无可用的
2、摩尔体积(m3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率:无可用的
7、单一同位素质量:157.881414Da
8、标称质量:158Da
9、平均质量:158.0339Da
化学性质
在乙醇、过氧化氢中使之氧化分解。
高锰酸钾是最强的氧化剂之一,作为氧化剂受pH影响很大,在酸性溶液中氧化能力最强。其相应的酸高锰酸HMnO4和酸酐Mn2O7,均为强氧化剂,能自动分解发热,和有机物接触引起燃烧。
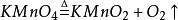
高锰酸钾具有强氧化性,在实验室中和工业上常用作氧化剂,遇乙醇即分解。在酸性介质中会缓慢分解成二氧化锰和氧。光对这种分解有催化作用,故在实验室里常存放在棕色瓶中。从元素电势图和自由能的氧化态图可看出,它具有极强的氧化性。在碱性溶液中,其氧化性不如在酸性中的强。作氧化剂时其还原产物因介质的酸碱性而不同。
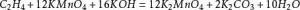
化学式:KMnO₄,相对分子质量为158.03395,高锰酸钾常温下即可与甘油(丙三醇)等有机物反应甚至燃烧;在酸性环境下氧化性更强,能氧化负价态的氯、溴、碘、硫等离子及二氧化硫等。与皮肤接触可腐蚀皮肤产生棕色染色;粉末散布于空气中有强烈刺激性。尿液、二氧化硫等可使其褪色。与较活泼金属粉末混合后有强烈燃烧性,危险。该物质在加热时分解:
·高锰酸钾在酸性溶液中还原产物为二价锰离子
·高锰酸钾在碱性溶液中还原产物一般为墨绿色的锰酸钾(K₂MnO₄)。
·高锰酸钾在中性环境下还原产物为二氧化锰。
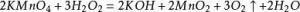
维生素C的水溶液能使高锰酸钾溶液褪色,并且维生素C溶液越浓,水溶液用量就越少。根据这一特性,就能够用高锰酸钾测定蔬菜或水果中的维生素含量。高锰酸钾造成的污渍可用还原性的草酸、维生素C等去除。强氧化剂,在酸性条件下氧化性更强,可以用做消毒剂和漂白剂,和强还原性物质反应会褪色,如SO₂、不饱和烃。
趣味实验:高锰酸钾还原
药品:1:5000高锰酸钾225ml蔗糖1.5gpH调整剂